Konfigurasi Elektron merupakan materi yang pasti akan ditemui pada mata pelajaran kimia. Jadi materi ini harus dipelajari dengan baik agar bisa paham dan juga mengerti, karena materi tersebut merupakan salah satu materi dasar dalam kimia.
Jadi apabila materi dasar sudah dikuasai, maka untuk lanjut ke materi selanjutnya bisa lebih mudah. Maka kimia bisa menjadi mata pelajaran yang menyenangkan karena bisa mengikuti setiap materi yang disampaikan dengan baik.
Terdapat beberapa hal penting yang harus diketahui untuk bisa memahami materi ini, yaitu langkah pertama harus tahu dan paham mengenai pengertiannya. Setelah itu, baru bisa lanjut ke materi selanjutnya yang lebih dalam seperti jenis-jenisnya dan lain sebagainya.
Pengertian dari Konfigurasi Elektron
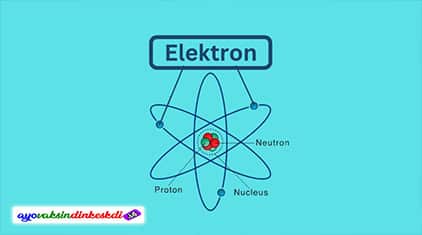
Konfigurasi elektron merupakan sebuah susunan dari elektron yang terdapat di dalam atom. Susunan dari elektron ini berdasarkan pada kulit atau orbital atom. Pada dasarnya, elektron yaitu sebuah partikel yang memiliki muatan negatif dan berputar mengelilingi inti atom.
Gambaran lebih jelasnya yaitu bisa dianalogikan sebagai berikut, yaitu inti atom bagaikan sebuah matahari dan planet-planet yang bergerak mengelilingi matahari diibaratkan sebagai elektron.
Tujuan mempelajari ini berdasarkan pada orbital yaitu untuk mempelajari mengenai sifat-sifat yang terdapat pada zat kimia. Selain itu, juga bisa mengetahui periode dan juga golongan dari suatu atom.
Cara menentukannya yaitu untuk periode atom ditunjukkan dengan nomor kulit yang paling besar pada isi elektron, atau pada bagian kulit paling luar. Sedangkan untuk golongan atom ditunjukkan oleh jumlah elektron paling luar atau disebut dengan elektron valensi.
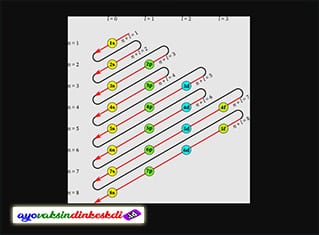
Cara untuk menentukan konfigurasi dari elektron yaitu ada dua, yang pertama bisa dengan jumlah dari elektron yang terdapat pada setiap kulit pada atom (cara K, L, M, N), cara ini digunakan pada atom yang termasuk pada unsur golongan IA-VIIIA.
Cara kedua yaitu bisa berdasarkan pada jumlah elektron yang terdapat pada subkulit atom (cara s, p, d, f), cara ini bisa digunakan untuk atom-atom yang terdapat pada unsur transisi atau golongan B.
Jenis-Jenis dari Konfigurasi Elektron
Ada dua jenis yang harus diketahui, berikut ini merupakan penjelasan lengkapnya:
1. Konfigurasi elektron kulit
Konfigurasi jenis ini ditemukan oleh seorang ilmuwan kimia bernama Niels Bohr. Hal ini juga yang membuat jenis dari konfigurasi ini dinamakan juga dengan konfigurasi elektron bohr.
Dijelaskan di dalamnya bahwa elektron akan bergerak mengelilingi inti atom dalam lintasan tertentu, dengan tingkatan energi yang bergantung pada setiap posisi dari lintasannya, sehingga energinya juga akan berbeda-beda. Lintasan inilah yang dikenal dengan kulit atom.
Dalam teori ini juga menjelaskan bahwa, konfigurasi elektron merupakan pengisian dari elektron yang dimulai dari tingkat energi atau kulit terendah. Urutan pengisiannya yaitu untuk kulit pertama dimulai dari kulit K (n = 1), L (n = 2), M (n = 3), N (n = 4) hingga seterusnya.
Jumlah dari elektron maksimal yang bisa ditempati pada setiap kulit pada elektron, bisa diketahui dengan memakai rumus 2.n2, contohnya yaitu sebagai berikut:
- Pada kulit K, maka jumlah elektron yang bisa ditampung yaitu sebanyak, 2.12 = 2
- Pada kulit L, maka jumlah elektron yang bisa ditampung yaitu sebanyak, 2.22 = 8
- Pada kulit M, maka jumlah elektron yang bisa ditampung yaitu sebanyak, 2.32 = 18
- Pada kulit N, maka jumlah elektron yang bisa ditampung yaitu sebanyak, 2.42 = 32, hingga seterusnya.
Contoh penerapanya yaitu sebagai berikut:
Ca merupakan sebuah unsur yang memiliki nomor atom yaitu 20, karena Ca tidak merupakan atom yang tidak bermuatan maka jumlah elektron dari Ca berjumlah 20 (nomor atom = jumlah dari elektron). Maka dari itu konfigurasi dari 20Ca = 2,8,8,2.
2. Konfigurasi elektron subkulit
Jenis konfigurasi ini memiliki sifat yang lebih kompleks daripada jenis sebelumnya. Jenis konfigurasi ini lebih menekankan adanya kebolehjadian yang bisa ditemukan dalam elektron, hal ini terjadi pada tingkatan subkulit dari suatu atom.
Pada tingkatan subkulit, di dalamnya juga terdapat sebuah orbital dimana merupakan sebuah tempat yang mungkin ditempati elektron. Orbital ini terbagi atas empat, yaitu ada orbital s, p, d dan juga f.
Dalam konfigurasi subkulit ini akan melibatkan bilangan kuantum di dalamnya, berikut ini merupakan penjelasannya:
a. Bilangan kuantum utama
Bilangan kuantum utama juga bisa dilambangkan menggunakan ‘n’. Bilangan kuantum utama menyatakan sebuah tingkat dari energi utama elektron dalam atom, atau bisa untuk menunjukkan kulit dari atom.
Jadi bisa dibilang kuantum utama yaitu gambaran dari lintasan elektron. Di dalam bilangan kuantum utama ini terdapat beberapa jenis kulit, diantaranya yaitu ada K, L, M, N dan juga seterusnya.
Dalam bilangan ini kulit pertama akan dilambangkan oleh K dimana nilai dari n = 1, nilai n akan bertambah 1 setiap kenaikan kulit. Jadi pada L nilai n = 2, pada L nilai n = 3, pada N nilai n = 4 dan juga seterusnya.
Nilai dari bilangan kuantum utama harus dalam bentuk positif, serta nilainya yaitu sama dengan atau bisa lebih dari satu. Nilai yang dihasilkan tidak mungkin menghasilkan nol atau bahkan dalam bentuk negatif.
Bisa disimpulkan juga bahwa bilangan ini merupakan penunjunjuk dari jarak terjauh antara nukleus dan elektron. Maka nilai n yang semakin besar bisa diartikan bahwa energinya dan ukuran orbitalnya juga semakin meningkat.
b. Bilangan kuantum azimuth
Bilangan ini dilambangkan dengan ‘l’ atau ‘ℓ’, dimana bilangan ini bisa digunakan untuk menyatakan bentuk dari orbital maupun subkulit atom. Nilai bilangan ini menunjukkan subkulit dari s, p, d ataupun f.
Penentuan nilainya yaitu dimulai dari l = 0 pada subkulit s, nilai l = 1 pada subkulit p, nilai l = 2 pada subkulit d, dan nilai l = 3 pada subkulit f. Contoh penerapannya yaitu bisa dengan memperhatikan tabel di bawah ini:
| Bilangan kuantum utama | Bilangan kuantum azimuth | Jumlah subkulit | Subkulit |
|---|---|---|---|
| K (n=1) | 0 | 1 | 1s |
| L (n=2) | 0, 1 | 2 | 2s, 2p |
| M (n=3) | 0, 1, 2 | 3 | 3s, 3p, 3d |
| N (n=4) | 0, 1, 2, 3 | 4 | 4s, 4p, 4d, 4f |
c. Bilangan kuantum magnetik
Bilangan kuantum selanjutnya yaitu ada magnetik yang dilambangkan dengan ‘m’. Bilangan kuantum ini menunjukkan posisi dari orbital dalam subkulit atom. Orbital sendiri yaitu sebuah tempat elektron bergerak dalam atom, dimana pada masing-masing orbital akan terisi sepasang elektron.
Nilai dari bilangan kuantum magnetik bergantung dengan bilangan kuantum azimuth,yang memiliki rentang yaitu m = -l hingga +l.
Contoh dari bilangan kuantum magnetik yaitu sebagai berikut:
- m = 0 (0), subkulit s
- m = 1 (-1, 0, 1), subkulit p
- m = 2 (-2, -1, 0, 1, 2), subkulit d
- m = 3 (-3, -2, -1, 0, 1, 2, 3), subkulit f
d. Bilangan kuantum spin
Bilangan kuantum yang terakhir yaitu ada spin, dilambangkan dengan ‘s’. bilangan kuantum ini menunjukkan arah dan juga kedudukan dari putaran elektron terhadap sumbunya. Cara menyatakan ini juga bisa menggunakan lambang tanda panah ke atas atau ke bawah.
Arah rotasi dari elektron hanya memiliki dua kemungkinan yaitu searah atau berlawanan arah dari jarum jam. Selain itu, nilai ‘s’ juga hanya bisa dinyatakan dengan ‘-½’ atau ‘+ ½’.
Apabila nilainya negatif maka bisa diartikan bahwa arah rotasinya berlawanan jarum jam, jadi bisa dilambangkan dengan simbol panah ke arah bawah (↓), sedangkan jika nilainya positif maka searah dengan jarum jam dan disimbolkan dengan panah ke arah atas (↑).
Penggambaran dari keempat bilangan kuantum dalam diagram orbital dinyatakan sebagai berikut:
- Orbital s = maksimal elektron yang dapat diisi yaitu 2
- Orbital p = maksimal elektron yang dapat diisi yaitu 6
- Orbital d = maksimal elektron yang dapat diisi yaitu 10
- Orbital f = maksimal elektron yang dapat diisi yaitu 14
Aturan dan Prinsip dalam Konfigurasi Elektron

Dalam menentukan konfigurasi elektron suatu atom tentu harus memperhatikan aturan maupun prinsip yang ada. Berikut ini merupakan penjelasan dari aturan dan prinsip-prinsip tersebut:
1. Aturan Aufbau
Salah satu aturan dalam yang paling digunakan yaitu ada aturan aufbau. Di dalam aturan ini dijelaskan mengenai pengisian orbital, jadi menurut prinsip ini dalam pengisian elektron dimulai dari subkulit yang memliki tingkatan energi dari paling rendah ke tinggi.
Dalam setiap subkulit memiliki batas maksimal dalam pengisian elektron, seperti yang sudah dijelaskan sebelumnya dalam bilangan kuantum spin.
Setelah orbital yang memiliki energi paling rendah sudah terisi penuh, maka elektron bisa menempati orbital yang memiliki tingkat energi lebih tinggi. Hal tersebut dilakukan seterusnya hingga semua elektron yang ada dalam suatu atom bisa menempati orbitalnya.
2. Aturan Hund
Aturan ini dikemukakan oleh ilmuwan bernama Friedrich Hund, maka dari itu dinamakan dengan aturan Hund. Di dalam aturan ini dijelaskan bahwa elektron yang terdapat dalam orbital pada subkulit cenderung tidak berpasangan.
Jadi orbital setingkat yang menempati sebuah subtingkat dengan energi sama, akan terisi oleh elektron satu persatu terlebih dahulu dengan arah spin yang searah. Setelah semua ruang yang tersedia sudah penuh, baru akan diisi dengan pasangannya yang memiliki arah spin berlawanan.
3. Larangan Pauli
Penemu dari larangan pauli yaitu seorang ilmuwan bernama Wolfgang Pauli, dimana dijelaskan bahwa di dalam suatu atom dengan nilai keempat bilangan kuantum yang sama, tidak boleh ada dua elektron.
Hal ini dikarenakan pada setiap orbital juga terdapat bilangan kuantum n, l, m, bedanya yaitu hanya pada kuantum spin atau s. Maka dari itu setiap orbital hanya bisa diisi dengan 2 elektron dengan nilai dari bilangan kuantum spin yang berlawanan.
Apabila elektron ketiga juga dimasukkan maka ada salah satu elektron sebelumnya dengan spin yang sama
4. Aturan penuh setengah penuh
Aturan dari konfigurasi yang terakhir yaitu ada penuh setengah penuh yang memiliki kaitan erat dengan hibridisasi elektron. Di dalam aturan ini dijelaskan bahwa elektron lebih cenderung untuk berpindah orbital, jika dapat membentuk susunan dari elektron yang lebih stabil.
Konfigurasi elektron merupakan materi dasar dalam kimia yang penting untuk diketahui dan dipahami dengan baik. Caranya yaitu bisa dengan mengetahui dan memahami mengenai pengertiannya, jenis-jenisnya serta aturan dan prinsip di dalamnya.
Baca Juga Artikel Lainnya:
- Fungsi Invers Pengertian, Rumus, Komposisi, Contoh Soal Dll
- Cara Menghitung Persen Di Excel, Kalkulator, Rumus, Contoh Soal
- Sel Tumbuhan dan Sel Hewan – Pengertian, Struktur Dll (Lengkap)
- Besaran Pokok dan Besaran Turunan Pengertian Serta Contohnya
- Sifat Koligatif Larutan, Pengertian, Klasifikasi, Manfaat Dll
- Letak Astronomis Indonesia (Pembahasan Lengkap) Penting!!!
- Contoh Soal Limit Fungsi Aljabar Beserta Jawabannya




