Sifat koligatif larutan merupakan salah satu materi yang pasti akan dipelajari pada pelajaran kimia. Materi ini sangat berkaitan dengan jenis zat-zat yang terlarut dan terjadi dalam kehidupan sehari-hari. Terdapat beberapa yang mungkin kurang dikenal oleh orang awam mengenai sifat koligatif dalam larutan.
Ketika membuat minuman dengan air panas dan gula tentu kamu tidak akan bisa melihat gula di dalamnya. Hal tersebut dikarenakan gula telah larut secara sempurna pada air panas. Kedua campuran antara air panas dengan gula tersebut merupakan salah satu contoh larutan.
Pengertian Sifat Koligatif Larutan
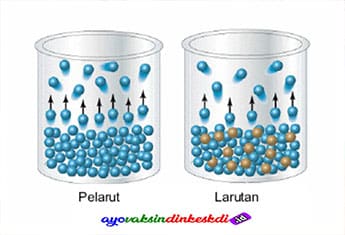
Pengertian sifat koligatif larutan adalah sifat yang bergantung pada konsentrasi zat terlarut, bukan pada jenis zat yang terlarut. Hukum Roult merupakan dasar dari hukum untuk sifat koligatif. Dalam bahasa latin koligatif merupakan colligare yang mempunyai arti berkumpul secara bersama.
Sifat ini mempunyai ketergantungan dengan pengaruh kolektif seluruh partikel. Selain itu, sifat ini sangat tidak bergantung pada keadaan partikel. Semakin banyak zat yang terlarut pada suatu larutan maka sifat koligatif akan menjadi semakin besar.
Definisi lain dari sifat koligatif adalah sifat yang tidak melihat kualitas melainkan kuantitas. Sifat-sifat yang memiliki ketergantungan dengan jenis zat terlarut diantaranya ialah kekentalan dan warna. Terdapat dua asumsi yang harus terpenuhi sebagai syarat untuk mengatakan suatu larutan dikatakan koligatif.
Asumsi yang pertama adalah zat yang terlarut akan sulit untuk mengalami penguapan. Dengan demikian zat terlarut tidak mampu memberikan kontribusi pada uapnya. Asumsi yang kedua adalah zat yang terlarut tidak mampu larut pada zat yang padat.
Konsentrasi Larutan
Konsentrasi larutan adalah jumlah partikel zat terlarut pada larutan yang dinyatakan dalam besaran. Terdapat tiga macam konsentrasi larutan, yakni molaritas (M), Fraksi mol (X), dan Molalitas (m). Berikut ulasan mengenai ketiga konsentrasi larutan yang ada:
1. Molaritas (M)
Molaritas adalah banyaknya atau jumlah mol zat yang mampu terlarut pada 1 liter larutan. Persamaan yang digunakan untuk menghitung molaritas (M) ialah:
Keterangan:
M = molaritas (M)
V = volume (L atau mL)
ρ = massa jenis (gr/mL)
n = mol zat (mol)
Mr = molekul relatif (gr/mol)
% = persen kadar zat
2. Fraksi Mol (X)
Fraksi mol adalah yang menyatakan perbandingan jumlah pelarut terhadap jumlah mol dari zat yang terlarut terhadap banyaknya mol pada semua komponen dalam suatu larutan. terdapat 3 fraksi mol dalam suatu larutan, yakni fraksi mol pelarut (Xp) dan fraksi mol terlarut (Xt).
Persamaan yang digunakan untuk menghitung fraksi mol (X) yakni:
Keterangan:
Xt = fraksi mol terlarut
Xp = fraksi mol pelarut
nt = mol terlarut
np = mol pelarut
p = massa pelarut (gr)
3. Molalitas (m)
Molalitas adalah sejumlah mol zat yang terlarut pada setiap 1000 gram pelarut. Persamaan yang digunakan untuk menghitung molalitas adalah sebagai berikut:
Keterangan:
m = molalitas
gr = massa terlarut (gr)
p = massa pelarut (gr)
Mr = molekul relatif (gr/mol)
Klasifikasi Sifat Koligatif Larutan

Telah dijelaskan sebelumnya bahwa sifat koligatif larutan tidak tergantung pada jenis zat terlarut. Sifat ini sangat tergantung pada sejumlah partikel atau zat terlarut dalam suatu larutan. Dalam klasifikasinya, sifat koligatif larutan dapat dikategorikan menjadi 4 macam.
Dimana keempat kategori yang dimaksud adalah kenaikan titik didih, penurunan tekanan uap, tekanan osmotic, dan penutunan titik beku. Molekul pelarut pada sistem pelarut murni akan mempengaruhi titik beku, titik didih, tekanan uap, serta tekanan osmotic.
Berbeda dengan sistem pelarut yang didalamnya memuat zat terlarut dan zat pelarut. Pada kenyataannya zat yang terlarut akan mengakibatkan adanya perubahan pada keempat kategori sifat koligatif larutan tersebut.
Misalnya yang terlarut berupa volatile mampu menyebabkan tekanan uap jenuh suatu larutan menjadi lebih besar daripada tekanan uap pada zat pelarut. Berbeda dengan zat terlarut yang non-volatil, dimana zat ini akan lebih mengarah untuk menurunkan tekanan uap pada suatu larutan.
Titik didih dan titik beku suatu larutan menjadi sifat koligatif larutan diakibatkan karena adanya perubahan pada tekanan uap. Berikut penjelasan lebih detail mengenai keempat kategori sifat koligatif pada larutan:
1. Penurunan Tekanan Uap
Pengertian penguapan adalah kejadian yang terjadi saat berbagai partikel yang adalah dalam zat cair memisahkan diri dari kelompoknya. Zat cair akan semakin mudah menguap ketika gaya tarik menarik antar molekul suatu larutan semakin lemah.
Sebaliknya semakin besar tekanan uap jenuh suatu larutan maka zat cair akan semakin mudah untuk menguap. Definisi tekanan uap adalah banyaknya atau sejumlah uap yang meninggalkan permukaan zat cair.
Uap akan berubah menjadi cair ketika partikel-partikel yang dimiliki zat cair memisahkan diri atau meninggalkan kelompoknya. Sedangkan pengertian tekanan uap sendiri adalah tekanan yang ada pada saat kesetimbangan antara banyaknya uap menjadi zat cair dan banyaknya partikel zat cair menjadi uap.
Seorang ahli kimia dari Prancis bernama F.M.Roult pada tahun 1880 menyatakan bahwa dalam proses melarutkan zat terdapat dampal, yaitu tekanan uap akan mengalami penurunan. Persamaan yang menyatakan hukum Roult tersebut adalah sebagai berikut:
Apabila tekanan uap berada di atas larutan yang mempunyai lambang P, maka akan menjadi:
Kemudian jika komponen larutan terdiri dari zat terlarut dan pelarut maka akan digunakan tetapan rumus sebagai berikut:
Maka:
Persamaan yang terbentuk ialah:
Keterangan:
Xp = fraksi mol yang menjadi pelarut
Xt = fraksi mol yang terlarut
P = tekanan uap pada larutan (mmHg)
P° = tekanan uap jenuh pada pelarut murni (mmHg)
ΔP = penurunan tekanan uap (mmHg)
2. Kenaikan Titik Didih
Titik didih pada suatu zat cair adalah suhu yang tetap dimana pada saat zat cair mendidih. Pada suhu tersebut, tekanan udara di sekitar akan sama dengan tekanan uap pada zat cair. Hal tersebut yang mengakibatkan adanya penguapan pada bagian zat yang cair.
Pengukuran titik didih pada zat yang cair menggunakan tekanan 1 atmosfer. Pada dasarnya titik didih pelarut yang murni selalu lebih rendah jika dibandingkan dengan titik didih larutan. Hal tersebut dikarenakan partikel pada zat yang terlarut menghambat kejadian penguapan suatu partikel.
Maka dari itu, penguapan partikel zat pelarut memerlukan energi yang jauh lebih besar. Rumus yang digunakan dalam perhitungan kenaikan titik didih:
Keterangan:
Tb = titik didih dalam larutan
Tb° = titik didih suatu pelarut
m = molalitas larutan (molal)
Kb = Tetapan kenaikan titik didih molal
ΔTb = kenaikan titik didih
3. Penurunan Titik Beku
Titik beku suatu larutan adalah suhu pada saat tekanan uap pada suatu cairan mempunyai kesamaan dengan tekanan uap pada zat padat. Dengan kata lain titik beku dapat dikatakan ketika zat cair mengalami pembekuan.
Adapun titik beku normal yang merupakan suhu pada saat suatu zat membeku atau meleleh pada keadaan normal atau pada tekanan 1 atm. Penurunan titik beku akan terjadi ketika zat yang terlarut ditambahkan pada pelarut murni.
Hal tersebut dikarenakan molekul-molekul pada pelarut tidak mudah berubah menjadi cair. Persamaan yang digunakan untuk menghitung penurunan titik beku adalah sebagai berikut:
Keterangan:
Tf = titik beku pada larutan
Tf° = titik beku pada pelarut
m = molalitas larutan (molal)
Kf = tetapan penurunan titik beku pada molal
ΔTf = penurunan titik beku
4. Tekanan Osmotik
Osmosis merupakan peristiwa dimana terjadi proses perpindahan suatu molekul yang terlarut antar larutan encer. Dimana perpindahan tersebut terjadi pada larutan yang kurang pekat ke larutan yang lebih pekat.
Dalam peristiwa osmosis akan berlangsung hingga terjadi pada suatu kesetimbangan atau kedua larutan isotonis telah tercapai. Hal yang menandai larutan osmosis adalah perubahan volume yang terjadi akan berhenti.
Adapun persamaan yang digunakan untuk menghitung tekanan osmotik:
Keterangan:
П = tekanan osmosis (atm)
R= Tetapan gas (0,082 atm L/mol K)
M = molaritas (mol/L)
N = mol terlarut (mol)
T = suhu (k)
v = volume larutan (mL atau L)
Manfaat Sifat Koligatif Pada Kehidupan Sehari-hari

Pada dasarnya sifat koligatif larutan dapat kamu temukan dalam kehidupan sehari-hari. Hal tersebut dikarenakan tidak dipungkiri bahwa sifat koligatif mempunyai manfaat dalam kehidupan sehari-hari. Berikut beberapa manfaat yang dimiliki oleh sifat koligatif pada suatu larutan:
1. Penurunan Tekanan Uap
Manfaat penurunan tekanan uap dalam kehidupan nyata diantaranya ialah:
- Memperoleh benzena yang murni dengan cara memisahkan campuran dengan destilasi yang bertingkat. Dalam hal ini menggunakan cara berupa prinsip perbedaan tekanan uap antara yang terlarut dengan zat pelarut.
- Digunakan pada kolam renang supaya ketika orang berenang dapat mengapung. Hal tersebut dikarenakan kadar garam yang dimiliki oleh kolam apung lebih tinggi dibandingkan dengan kadar garam rata-rata pada suatu larutan. dengan demikian air akan kesulitan untuk mengalami penguapan karena kadar garam yang menyebabkan turunnya uap pelarut.
2. Kenaikan Titik Didih
Dalam kehidupan sehari-hari, kenaikan titik didih mempunyai manfaat sebagai berikut:
- Dalam proses destilasi yang merupakan proses pemisahan senyawa larutan dengan memakai cara pendidihan. Destilasi mempunyai manfaat untuk memisahkan zat pelarut dengan larutan. Cara yang paling sederhana untuk hal ini adalah dengan menaikkan suhu secara perlahan.
- Proses memasak dapat tidak terlalu lama dengan menambahkan garam pada saat masakan berupa air yang mendidih.
3. Penurunan Titik Beku
Berikut manfaat yang akan didapatkan pada penurunan titik beku:
- Pada radiator mobil dapat membuat zat anti beku dengan cara memberi tambahan cairan yang tidak mudah membeku, misalnya etilen glikol.
- Menaburi jalan raya dengan menggunakan campuran garam CaCl2 dan NaCl yang bertujuan untuk mencairkan salju pada jalan raya.
4. Tekanan Osmotik
Tekanan osmotic dapat diterapkan dalam kehidupan sehari-hari sebagai berikut:
- Dimanfaatkan dalam mesin pencuci darah untuk pasien yang mengalami gagal ginjal, cara kerja yang digunakan adalah mesin dialisis.
- Menaburkan garam dapur pada tumbuh lintah untuk membasmi lintah.
- Dapat digunakan untuk mengontrol sel supaya tidak mengalami kerusakan atau pecah.
Sifat koligatif larutan merupakan salah satu materi kimia yang banyak diterapkan dalam kehidupan sehari-hari. Hal tersebut dibuktikan dengan banyaknya manfaat sifat koligatif yang ada pada suatu larutan untuk kehidupan nyata.
Baca Juga Artikel Lainnya:
- Contoh Teks Anekdot Singkat Lucu Beserta Strukturnya
- Contoh Soal Antonim dan Sinonim Beserta Kunci Jawabannya
- Contoh Soal Jangka Sorong Beserta Fungsi dan Jenisnya
- Contoh Soal Limit Fungsi Aljabar Beserta Jawabannya
- Notasi Sigma Kelas 11 – Pengertian, Rumus, dan Contoh Soal
- Bilangan Berpangkat Pecahan, Bentuk Akar, dan Contoh Soal
- Besaran Turunan Beserta Satuan, Dimensi, dan Contohnya




