Di dalam pelajaran kimia, tabel periodik atau sistem periodik menjadi salah satu bagian penting karena menampilkan berbagai macam unsur yang ada. Pada tabel tersebut juga terdapat banyak informasi penting mengenai setiap unsur sehingga sangat berguna dalam memahami berbagai materi kimia.
Unsur-unsur yang ada di sistem periodik disusun berdasarkan kenaikan nomor atomnya dan juga dikelompokkan sesuai kemiripan sifatnya. Bagaimana sistem periodik unsur bisa terbentuk, cara membacanya serta kecenderungan sifat keperiodikan unsur akan dibahas dalam ulasan berikut ini.
Sejarah Perkembangan Tabel Periodik Unsur Kimia
Untuk sampai ke bentuk sistem periodik yang saat ini digunakan, sejarahnya terbilang cukup panjang dan mengalami beberapa kali perubahan. Selain karena jumlah unsur yang sudah ditemukan pada masanya belum lengkap, keterbatasan teknologi dan informasi juga menjadi kendalanya.
Perkembangan sistem periodik dimulai lebih dari 200 tahun yang lalu dan terus disempurnakan beberapa kali hingga sampai ke bentuk yang saat ini digunakan. Berikut ini adalah sejarah perkembangan sistem periodik dari yang pertama hingga yang terbaru.
1. Tabel Periodik Buatan Antoine Lavoisier
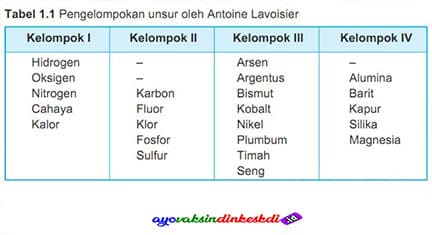
Seorang ilmuwan kimia asal Prancis bernama Antoine Laurent Lavoisier menjadi tokoh pertama yang mengembangkan sistem periodik pada tahun 1789. Di masa itu hanya ada sedikit unsur yang ditemukan dan dipublikasikan olehnya namun merupakan penemuan yang sangat penting.
Unsur-unsur yang sudah ditemukan saat itu hanya dikelompokkan berdasarkan pembagian sifatnya yaitu logam, non-logam, gas dan juga tanah.
| Unsur Kelompok I | Unsur Kelompok II | Unsur Kelompok III | Unsur Kelompok IV |
| Hidrogen | Karbon | Arsen | Alumina |
| Oksigen | Fluor | Argentus | Barit |
| Nitrogen | Klor | Bismut | Kapur |
| Cahaya | Fosfor | Kobalt | Silika |
| Kalor | Sulfur | Nikel | Magnesia |
| Plumbum | |||
| Timah | |||
| Seng |
2. Tabel Periodik Dobereiner
Berikutnya di tahun 1829 ada seorang ahli kimia dari Jerman yaitu Johann Wolfgang Dobereiner yang membuat sistem periodik untuk menyempurnakan yang sudah ditemukan oleh Lavoisier. Yang menjadi dasar penyusunan tabel periodik Dobereiner adalah massa atomnya.
Dobereiner mengelompokkan tiga unsur dalam satu kelompok dengan aturan Triad atau Triade. Dalam aturan ini, massa atom unsur pertama dijumlahkan dengan massa atom unsur ketiga, kemudian unsur kedua akan memiliki massa atom rata-rata dari unsur pertama dan ketiga.
Berikut adalah contoh pengelompokkan unsur dengan sistem Triad atau Triade menurut Dobereiner.
| Kelompok | Lambang Unsur | Massa Atom |
| Kelompok 1 | Li | 7 |
| Na | 23 | |
| K | 39 | |
| Kelompok 2 | Cl | 35,5 |
| Br | 80 | |
| I | 127 |
3. Tabel Periodik John Newlands
Sistem periodik berikutnya disempurnakan lagi oleh kimiawan dari Inggris bernama John Newlands. Newlands mengelompokkan unsur-unsur berdasarkan kenaikan massa atomnya dengan sistem oktaf. Menurutnya, sifat kimia dan fisika dari unsur akan berulang pada urutan ke delapan.
Artinya, unsur ke delapan akan memiliki sifat yang mirip dengan unsur pertama layaknya oktaf pada musik yang pada nada ke 8 akan kembali ke “do”. Berikut adalah tabel pengelompokkan unsur berdasarkan aturan oktaf dari Newlands.
4. Sistem Periodik Dmitri Mendeleev
Selanjutnya pada tahun 1871, seorang ahli kimia yang berasal dari Rusia bernama Dmitri Mendeleev menyempurnakan sistem periodik sebelumnya. Mendeleev mengelompokkan unsur-unsur yang memiliki sifat yang mirip ke dalam satu kolom yang disebut golongan.
Kemudian unsur-unsur diurutkan berdasarkan kenaikan massa atom relatif dalam satu baris yang disebut dengan periode. Di tebel yang dibuat olehnya, disisakan beberapa celah kosong yang diyakini akan menjadi tempat unsur yang belum ditemukan pada saat itu.
Sistem yang dibuat Mendeleev ini kemudian menjadi dasar sistem periodik modern sehingga Ia disebut sebagai penemu sistem periodik unsur kimia. Berikut ini adalah sistem pengelompokkan unsur berdasarkan aturan dari Mendeleev.
5. Sistem Periodik Henry Moseley
Setelah berbagai penemuan sains hingga akhirnya ditemukan partikel penyusun atom seperti elektron, proton, dan neutron, akhirnya sistem periodik pun ikut berkembang. Adalah Henry Moseley yang kemudian menyempurnakan sistem periodik dari Mendeleev pada tahun 1914.
Moseley kemudian menemukan bahwa nomor atom merupakan jumlah dari partikel positif yang ada di dalam sebuah atom. Aturan tentang nomor atom ini yang kemudian dijadikan dasar dalam pengelompokkan unsur di sistem periodik yang baru dan berlaku sampai saat ini.
Setelah semakin banyak unsur yang ditemukan di alam, kemudian akhirnya sistem periodik yang sudah disusun oleh Moseley menjadi lengkap dan menjadi tabel periodik yang digunakan hingga saat ini.
Cara Membaca Tabel Periodik Unsur Kimia
Pada sistem periodik yang dipakai saat ini, unsur-unsur disusun berdasarkan kenaikan nomor atomnya secara horizontal dan berdasarkan sifatnya secara vertikal. Bentuk tabelnya tidak merata karna memang disesuaikan sesempurna mungkin untuk mengelompokkannya dengan baik.
Untuk bisa membaca sistem periodik, ada dua hal dasar yang perlu dipahami yaitu yang disebut dengan golongan dan periode. Golongan merupakan pengelompokkan unsur dalam satu kolom (vertikal) dan periode adalah kelompok unsur dalam satu baris (horizontal).
1. Golongan dalam Sistem Periodik Unsur
Unsur-unsur yang berada dalam satu kolom (vertikal) yang sama artinya berada dalam satu golongan yang sama. Terdapat 2 golongan dalam sistem periodik yaitu golongan A yang merupakan golongan utama, lalu golongan B yang merupakan golongan logam transisi.
Golongan A terbagi menjadi 8 golongan mulai dari IA sampai VIIIA yang dalam tabel terpisahkan oleh golongan B di tengahnya. Setiap golongan memiliki nama masing-masing dengan kemiripan sifat dari unsur-unsur penyusunnya.
| Gol IA(Alkali) | Gol IIA(Alkali Tanah) | Gol IIIA(Boron-Aluminium) | Gol IVA(Karbon-Silikon) | Gol VA(Nitrogen-Fosfor) | Gol VIA(Oksigen-Belerang) | Gol VIIA(Halogen) | Gol VIIIA(Gas Mulia) |
| H | Be | B | C | N | O | F | He |
| Li | Mg | Al | Si | P | S | Cl | Ne |
| Na | Ca | Ga | Ge | As | Se | Br | Ar |
| K | Sr | In | Sn | Sb | Te | I | Kr |
| Rb | Ba | Tl | Pb | Bi | Po | At | Xe |
| Cs | Ra | Rn | |||||
| Fr |
Berikutnya ada golongan B yang disebut dengan golongan logam transisi yang terletak di antara golongan IIA dan IIIA. Di dalam tabel, golongan B paling kiri adalah IIIB dan berlanjut sampai VIIIB yang memiliki 3 kolom kemudian dilanjutkan dengan golongan IB dan IIB di sebelah kanannya.
Letak golongan suatu unsur bisa dilihat dari konfigurasi elektron dari atom unsur tersebut dengan mudah.
2. Periode dalam Sistem Periodik Unsur
Periode merupakan kelompok unsur dalam satu baris (horizontal) dan tersusun dari unsur dengan kenaikan nomor atom yang teratur. Terdapat 7 periode di dalam sistem periodik yang setiap periodenya mempunyai jumlah unsur yang berbeda.
Letak unsur dalam periode di sistem periodik menunjukkan jumlah kulit atau bilangan kuantum utama dari suatu atom unsur.
- Periode 1 terdiri dari 2 unsur
- Periode 2 dan 3 terdiri dari 8 unsur
- Periode 4 dan 5 terdiri dari 18 unsur
- Periode 6 terdiri dari 32 unsur yang di antaranya dalah unsur deret lantanida yang biasanya ditaruh di bagian bawah tabel.
- Periode 7 berisi unsur yang belum lengkap dan juga terdapat deret aktinida yang biasa diletakkan di bawah tabel, di bawah deret lantanida.
Letak suatu unsur di dalam sistem periodik dan konfigurasi elektron sangatlah berkaitan erat. Karena susunan konfigurasi elektron tersebut yang kemudian bisa dijadikan cara untuk menentukan letak dari suatu unsur di sistem periodik mulai dari golongan dan juga periodenya.
Arti Warna pada Tabel Periodik Unsur Kimia
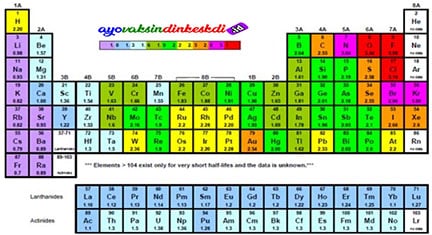
Di beberapa tabel sistem periodik unsur, terdapat warna-warna tertentu pada unsur-unsurnya. Umumnya warna-warna yang ada di sistem periodik menunjukkan sifat dari unsur seperti logam, semi-logam dan nonlogam.
Selain itu ada pula beberapa sistem periodik unsur yang memberi warna berdasarkan wujud dari suatu unsur dalam keadaan bebas mulai dari padat, cair dan gas. Namun biasanya di sekitar tabel akan disediakan petunjuk mengenai arti dari warna yang ada di setiap unsur.
Hubungan Antara Tabel Periodik dan Sifat Keperiodikan Unsur
Pada unsur-unsur yang terdapat dalam susunan sistem periodik, terdapat kecenderungan dari beberapa sifat yang disebut dengan sifat keperiodikan unsur. Berikut ini adalah beberapa sifat keperiodikan unsur dan hubungannya dengan susunan sistem periodik.
1. Sifat Jari-Jari Atom
Jari-jari atom merupakan jarak antara inti atom ke orbital elektron paling luar dari suatu atom. Dalam satu golongan, semakin bawah letak unsur maka akan semakin besar jari-jari atomnya. Sedangkan dalam satu periode, semakin kiri letak unsur dalam sistem periodik maka makin besar jari-jari atomnya.
2. Sifat Energi Ionisasi
Energi ionisasi adalah energi yang dibutuhkan untuk melepas satu elektron terluar dari suatu atom. Dalam satu golongan, unsur yang terletak lebih atas akan memiliki energi ionisasi makin besar. Dalam satu periode, unsur yang letaknya lebih kanan akan memiliki energi ionisasi lebih besar.
Semakin besar nilai energi ionisasi suatu unsur, artinya atom dari unsur tersebut akan lebih sulit untuk melepaskan elektron sehingga akan lebih bersifat nonlogam.
3. Sifat Afinitas Elektron
Afinitas elektron merupakan energi yang dilepaskan saat suatu atom mengikat 1 elektron dan membentuk ion negatif. Semakin kanan letak unsur dalam periode yang sama, semakin besar pula afinitas elektronnya. Sedangkan semakin atas letak unsur dalam satu golongan maka makin besar juga afinitas elektronnya.
Semakin besar afinitas elektron artinya semakin negatif energi yang dilepaskan, atau berarti unsur tersebut akan lebih mudah untuk mengikat elektron sehingga sifat logamnya semakin kecil.
4. Sifat Keelektronegatifan
Keelektronegatifan adalah kecenderungan suatu atom untuk menarik pasangan elektron dari atom lain di dalam sebuah ikatan kovalen. Dalam satu golongan, unsur-unsur memiliki kecenderungan kenaikan keelektronegatifan semakin ke atas.
Sedangkan dalam satu periode, kecenderungan kenaikan keelektronegatifan terjadi semakin ke kanan letaknya dalam sistem periodik. Namun perlu diingat bahwa unsur-unsuh Gas Mulia atau golongan VIIIA tidak memiliki keelektronegatifan alias keelektronegatifannya bernilai 0.
Tabel periodik telah mengalami banyak perkembangan dalam sejarahnya hingga sampai ke sistem yang dipakai hingga kini. Ada banyak informasi yang bisa didapat dari letak unsur-unsur di dalam sistem periodik yang berguna untuk memahami berbagai gejala dan sifat dalam suatu unsur maupun senyawa.
Baca Juga Artikel Lainnya:
- Contoh Teks Editorial Singkat Beserta Strukturnya Terbaru 2022
- Contoh Kliping di Word dan Tulis Tangan yang Baik & Benar
- Contoh Majas Antonomasia Dalam Hikayat dan Artinya
- Contoh Teks Eksposisi Singkat Beserta Ciri & Struktur Lengkap
- 5 Trik Sukses Hadapi Ujian Semester dengan Nilai Tertinggi
- Contoh Surat Lamaran Kerja yang Baik dan Benar + File Word




